港大醫學院成功研發篩選治療肝癌新藥物組合療法
2021-12-20 19:06 
港大醫學院研究團隊提出一項新的肝癌組合治療方法,將現有一種用於血管擴張的藥物「艾芬地爾」(ifenprodil)轉化為新的肝癌治療藥物,與治療肝癌的一線標靶藥物「索拉非尼」(sorafenib)聯合使用,為肝癌患者帶來新曙光。團隊運用其開發的「CombiGEM-CRISPR v2.0平台」將多個潛在的藥物標靶基因大量組裝,有系統地進行組合剔除,加快從中篩選出有效肝癌治療的新藥物組合。相關研究成果現已於國際科學期刊《Cancer Research》上發表。
港大醫學院解釋,肝癌是全球第六大常見的癌症,死亡率更是癌症中的第三高。現時治療選擇非常有限,大部分患者接受化療或標靶藥物治療,但治療成效不高。用於治療晚期肝癌的「索拉非尼」的治療效果雖比傳統化療佳,但主要用作暫時舒緩病情,部分患者隨後更會出現抗藥性。藥物組合療法旨在以多管齊下的策略追擊癌症,能增加不同藥物組合的選擇,同時減少發生單一用藥,導致抗藥性甚至復發的機會。通過精準的CRISPR-Cas9基因剔除技術針對核糖核酸(RNAs)進行基因靶向定位,可以有效和準確地剔除任何潛在的基因靶點,對鑑定癌症藥物靶點和開發新的聯合療法尤為重要。
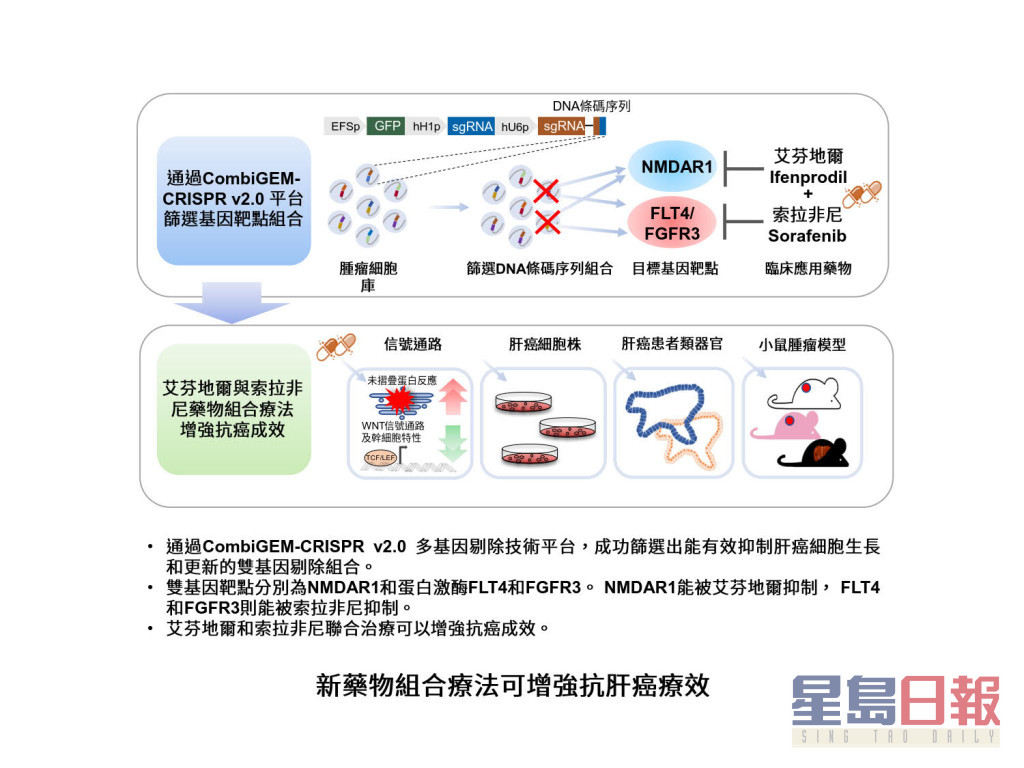
團隊運用其開發的平台,把多個潛在的肝癌藥物標靶基因大量組裝並進行雙基因組合剔除,同時利用基因編輯對應脫氧核糖核酸(DNA)特定的條碼序列(barcode DNA sequence)進行標記。透過高通量測序技術來測量DNA條碼序列的頻率變化,於眾多組合中快速地找出能有效抑制肝癌細胞生長及生存的雙基因剔除組合。隨後配合現有藥物聯合抑制該基因組合,以測試其抗癌效果。與傳統方法相比,這方法大大提高了測試藥物配對的效率和避免繁複的細胞實驗操作,更可以將現有的抗癌藥物和一些非用於治療癌症藥物轉化並組合為新治癌方案。
團隊針對肝癌幹細胞的基因靶點,通過該平台,成功地篩選出兩組能有效抑制肝癌細胞生長和更新的雙基因剔除組合。這兩個組合擁有共同的基因靶點NMDAR1,能被「艾芬地爾」所抑制。而與NMDAR1配對的另外兩個基因靶點均是「索拉非尼」所抑制的蛋白激酶(FLT4和FGFR3)。團隊亦在肝癌患者臨床樣本的數據分析中,發現患者NMDAR1的水平越低,存活期會較長。
此外,團隊還拆解了聯合使用「「艾芬地爾」」和「索拉非尼」抑制肝癌細胞的分子機制─在多種實驗模型包括肝癌細胞、肝癌病人類器官以及小鼠腫瘤模型中,組合療法可以有效地誘導未摺疊蛋白反應(unfolded protein response),促使細胞周期停滯(cell cycle arrest) ,引致癌細胞凋亡,並下調WNT幹細胞信號通路,從而顯著減少癌細胞的生長以及抑制肝癌幹細胞特性。
共同領導研究的生物醫學學院副教授馬佳宜表示,與研發全新藥物相比,轉化現有藥物能夠大大降低研究時間和成本,提高研發效率,同時也避免了使用全新藥物帶來未知的安全問題,有更大機會在臨床患者中進行測試。研究成功篩選出一個由已在臨床應用的藥物組成的組合療法,以作進一步測試,期望這全新的組合療法能夠拯救或延長肝癌病人的性命。
另一位共同領導研究的生物醫學學院助理教授黃兆麟表示該平台的特色是透過快速、簡便和精準的篩選方法,找出潛在藥物靶點和靶點組合,能廣泛應用於不同疾病上,大大拓展了尋找新藥物組合療法和轉化現有藥物的可能。










最新回應